Hoá học 10 Bài 24: Sơ lược về hợp chất có oxi của clo
Tóm tắt bài
1.1. Thành phần, tính chất và ứng dụng của nước Javel và clorua vôi
| Nước Javel | Clorua vôi | |
| Thành phần |
Dung dịch: NaCl và NaClO. NaClO ⇔ HClO natri hipoclorit axit hipoclorơ |
- CTPT: CaOCl2 - CTCT:
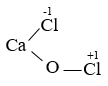 → muối hỗn tạp. |
| Tính chất |
- Tính tẩy màu, sát trùng. - NaClO là muối của axit yếu:
NaClO + CO2 + H2O → HClO + NaHCO3 - NaClO, HClO: có tính oxi hóa rất mạnh. |
- Chất bột, màu trắng, xốp. - Tính oxi hóa mạnh:
CaOCl2 + 2HCl →CaCl2 + Cl2+ H2O - Tác dụng với CO2 trong không khí ẩm: 2CaOCl2 + CO2 + H2O → 2HClO + CaCO3 + CaCl2 |
| Ứng dụng |
- Tẩy trắng vải, sợi, giấy, ... - Tẩy uế chuồng trại chăn nuôi, nhà vệ sinh |
- Tẩy trắng, tẩy uế. - Tinh chế dầu mỏ. - Xử lí các chất độc, bảo vệ môi trường. |
1.1.1 Nước Javel
- Nước Javel là dung dịch hỗn hợp muối NaCl và NaClO.
- Muối NaClO có tính oxi hóa rất mạnh, do vậy nước Javel có tính tẩy màu, sát trùng, tẩy trắng vải, sợi, giấy và dùng sát trùng chuồng trại chăn nuôi, nhà vệ sinh.
- NaClO là muối của axit rất yếu, yếu hơn axit cacbonic nên dễ tác dụng với CO2 của không khí tạo thành axit HClO có tính oxi hóa mạnh.
⇒ nước Javel không để được lâu trong không khí.
1.1.2. Clorua vôi CaOCl2
- Clorua vôi là chất bột màu trắng, xốp, mùi xốc, có tính oxi hóa mạnh.
- Tác dụng với axit clohidric cho Cl2
CaOCl2 + 2HCl → CaCl2 + Cl2 + H2O
- Trong không khí ẩm, clorua vôi tác dụng với CO2 tạo ra axit hipoclorơ
1.2. Điều chế nước Javel và clorua vôi
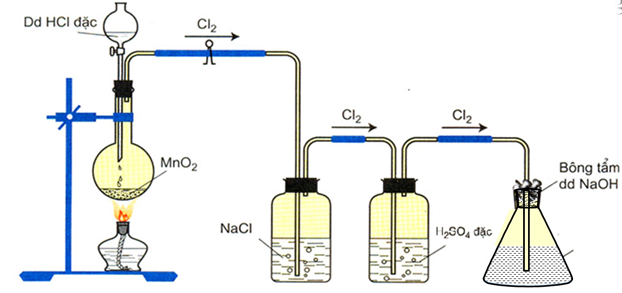
1.2.1. Điều chế nước Javel
- Trong phòng thí nghiệm:
Cho khí clo tác dụng với NaOH loãng ở nhiệt độ thường:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Hình 1: Sơ đồ điều chế nước Javel trong phòng thí nghiệm
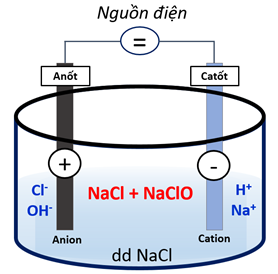
- Trong công nghiệp:
Điện phân dung dịch NaCl nồng độ 15 – 20% trong thùng điện phân không có màng ngăn.
\(2NaCl + 2{H_2}O \to 2NaOH + {H_2} \uparrow + C{l_2} \uparrow \)
\(C{l_2} + 2NaOH \to NaCl + NaClO + H{}_2O\)
Hình 2: Điều chế nước Javel trong công nghiệp
1.2.2. Điều chế clorua vôi
Cho clo tác dụng với vôi tôi (sữa vôi) ở 30oC thu được clorua vôi:
Cl2 + Ca(OH)2 → CaOCl2 + H2O (to = 30OC)

Hình 3: Clorua vôi
Bài 1:
Viết phương trình phản ứng biểu diễn sơ đồ chuyển hóa sau:
Hướng dẫn:
(1) \(2KMn{O_4} + 16HCl \to 2KCl + 2MnC{l_2} + 5C{l_2} \uparrow + 8{H_2}O\)
(2) \(C{l_2} + 2NaOH \to NaCl + NaClO + {H_2}O\)
(3) \(Mn{O_2} + 4HCl \to MnC{l_2} + C{l_2} \uparrow + 2{H_2}O\)
(4) \(C{l_2} + Ca{(OH)_2} \to CaOC{l_2} + {H_2}O\) ĐK: Ở 30oC
(5) \(CaOC{l_2} + 2HCl \to CaC{l_2} + C{l_2} + {H_2}O\)
Hoặc \(CaOC{l_2} \to CaC{l_2} + \frac{1}{2}{O_2}\) ĐK: toc
Bài 2:
Viết các phương trình phản ứng điều chế nước Javel từ các chất có trong phòng thí nghiệm: NaCl, MnO2, H2SO4 đặc, NaOH
Hướng dẫn:
- Điều chế axit HCl từ NaCl, H2SO4 đặc, H2O
NaCl (r) + H2SO4 (đặc) → NaHSO4 + HCl ĐK: tOC
- Từ HCl và MnO2 điều chế khí Cl2
MnO2 + 4HCl (đặc) → MnCl2 + Cl2 + 2H2O ĐK: tOC
- Từ Cl2 và dung dịch NaOH loãng nguội điều chế nước Javel
Cl2+ 2NaOH → NaCl + NaClO + H2O
Bài 3:
Chỉ dùng một thuốc thử, hãy nhận biết các dung dịch mất nhãn sau: HCl, HClO, NaCl, NaClO
Hướng dẫn:
Sử dụng quỳ tím:
- HCl → Qùy tím hóa đỏ
- HClO → Qùy tím không đổi màu
- NaCl → Qùy tím mất màu
- NaClO → Qùy tím hóa đỏ rồi mất màu
3. Luyện tập Bài 24 Hóa học 10
Sau bài học cần nắm: Thành phần hóa học, ứng dụng, nguyên tắc sản xuất cũng như tính oxi hóa mạnh của một số hợp chất có oxi của clo (nước Gia-ven, clorua vôi).
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 10 Bài 24 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Oxi nguyên tử có tính oxi hóa mạnh.
- B. Cl+ có tính oxi hóa mạnh.
- C. Cl- và oxi nguyên tử có tác dụng phá hủy mạnh.
- D. Do các muối tự phân hủy.
-
- A. Clorua vôi rẻ tiền hơn.
- B. Clorua vôi có hàm lượng hipoclorit cao hơn.
- C. Clorua vôi để bảo quản và dễ chuyên chở hơn.
- D. Cả A, B, C.
-
- A. Clorua vôi là muối tạo bởi một kim loại liên kết với một loại gốc axit
- B. Clorua vôi là muối tạo bởi một kim loại liên kết với hai loại gốc axit
- C. Clorua vôi là muối tạo bởi hai kim loại liên kết với một loại gốc axit
- D. Clorua vôi không phải là muối
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 10 Bài 24.
Bài tập 24.4 trang 57 SBT Hóa học 10
Bài tập 24.5 trang 57 SBT Hóa học 10
Bài tập 24.6 trang 57 SBT Hóa học 10
Bài tập 24.7 trang 57 SBT Hóa học 10
Bài tập 24.8 trang 58 SBT Hóa học 10
Bài tập 24.9 trang 58 SBT Hóa học 10
Bài tập 24.10 trang 58 SBT Hóa học 10
Bài tập 1 trang 134 SGK Hóa học 10 nâng cao
Bài tập 2 trang 134 SGK Hóa học 10 nâng cao
Bài tập 3 trang 134 SGK Hóa học 10 nâng cao
Bài tập 4 trang 134 SGK Hóa học 10 nâng cao
Bài tập 5 trang 134 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 24 Chương 5 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 10
Lớp 10 - Năm thứ nhất ở cấp trung học phổ thông, năm đầu tiên nên có nhiều bạn bè mới đến từ những nơi xa hơn vì ngôi trường mới lại mỗi lúc lại xa nhà mình hơn. Được biết bên ngoài kia là một thế giới mới to và nhiều điều thú vị, một trang mới đang chò đợi chúng ta.
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK