Hoá học 10 Bài 2: Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị
Tóm tắt bài
1.1. Hạt nhân nguyên tử
1.1.1. Điện tích hạt nhân
- Nếu hạt nhân nguyên tử có Z hạt proton thì điện tích hạt nhân là Z+ và số đơn vị điện tích hạt nhân là Z.
- số đơn vị điện tích hạt nhân = số p = số e = Z
1.1.2. Số khối:
- Số khối của hạt nhân (A) bằng tổng số prton(Z) và tổng số nơtron (N)
- Công thức: A = Z + N
1.2. Nguyên tố hóa học
1.2.1. Định nghĩa
- Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân nhưng khác số khối.
- Những nguyên tử có cùng điện tích hạt nhân đều có tính chất hóa học giống nhau.
1.2.2. Số hiệu nguyên tử:
- Số đơn vị điện tích hạt nhân (Z) của một nguyên tố được gọi là số hiệu nguyên tử của nguyên tố đó.
- Vậy: số hiệu nguyên tử =số đơn vị điện tích hạt nhân = số p = số e =Z
1.2.3. Kí hiệu nguyên tử \({}_Z^AX\)
- X là kí hiệu nguyên tố.
- A là số khối (A = Z + N)
- Z là số hiệu nguyên tử
1.3. Đồng vị
- Đồng vị là những nguyên tử có cùng số proton nhưng khác số nơtron, do đó số khối của chúng khác nhau.
- Ví dụ:
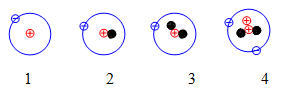
- Hiđro có 3 đồng vị là: \({}_1^1H;{}_1^2H;{}_1^3H\)
- Clo có 2 đồng vị là: \({}_{17}^{35}Cl;{}_{17}^{37}Cl\)
Hình 1: Sơ đồ cấu tạo các nguyên tử đồng vị của nguyên tố Hidro
1.4. Nguyên tử khối và nguyên tử khối trung bình
1.4.1. Nguyên tử khối
- Nguyên tử khối là khối lượng tương đối của nguyên tử.
- Công thức: A = mP + mn
- Nguyên tử khối cho biết khối lượng nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử.
1.4.2. Nguyên tử khối trung bình
- Công thức: \(\overline A = \frac{{{A_1}.x + {A_2}.y + {A_3}.z + ....{A_n}.n}}{{100}}\)
- Trong đó A1, A2, A3,….là số khối của các đồng vị.
- x, y, z,….là thành phần trăm của các đồng vị.
- Ví dụ 1: Clo có hai đồng vị là \({}_{17}^{35}Cl;{}_{17}^{37}Cl\)
Nguyên tử khối trung bình của Cl là: \(\overline A = \frac{{{A_1}.x + {A_2}.y}}{{100}} = \frac{{35.75,77 + 37.24,23}}{{100}} = 35,5\)
- Ví dụ 2: Xét 50 nguyên tử X thì có 27 nguyên tử X1 và 23 nguyên tử X2.
Số khối A1 = 35 + 44 =79; A2 =35 + 46=81
Ta có : \(\overline A = \frac{{79.27 + 81.23}}{{50}} = 79,92\)
Bài 1:
Nguyên tử của nguyên tố X có tổng số hạt là 40 .Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt .Nguyên tố X có số khối là :
Hướng dẫn:
Tổng số hạt là 40 ⇒ e + p + n = 40 ⇔ 2p + n = 40 (1)
Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Trong đó hạt mạng điện là p và e ; hạt không mang điện là notron ta có:
e + p - n = 12 ⇔ 2p - n = 12 (2)
Từ (1) và (2) ta có hệ phương trình:
\(\left\{ \begin{array}{l} 2p + n = 40\\ 2p - n = 12 \end{array} \right. \Rightarrow \left\{ \begin{array}{l} p = 13 = e\\ n = 14 \end{array} \right.\)
Số khối A = p + n = 13 + 14 = 27
Bài 2:
Nguyên tố Cu có hai đồng vị bền là \({}_{29}^{63}Cu\) và \({}_{29}^{65}Cu\) . Nguyên tử khối trung bình của Cu là 63,54. Tỉ lệ % đồng vị \({}_{29}^{63}Cu\) , \({}_{29}^{65}Cu\) lần lượt là
Hướng dẫn:
Gọi tỉ lệ phần trăm của \({}_{29}^{63}Cu\) và \({}_{29}^{65}Cu\) lần lượt là x và (100 - x)
Áp dụng công thức tính phân tử khối trung bình
\(\begin{array}{l} \overline A = \frac{{63x + 65(100 - x)}}{{100}} = 63,54\\ \Rightarrow x = 73\% \end{array}\)
Vậy tỉ lệ phần trăm của \({}_{29}^{63}Cu\) và \({}_{29}^{65}Cu\) lần lượt là: 73% và 27%
Đối với bài toán đồng vị chỉ chứa 2 đồng vị thì các em có thể sử dụng phương pháp đường chéo để tìm nguyên tử khối trung bình, tỉ lệ phần trăm mỗi đồng vị.
Bài 3:
Cho hợp chất MX3, biết:
Tổng số hạt p , n , e là 196 trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 60
Nguyên tử khối của X lớn hơn của M là 8
Tổng 3 loại hạt (p , n , e) trong ion X– nhiều hơn trong ion M3+ là 16
Hãy xác định M và X thuộc đồng vị nào của 2 nguyên tố đó
Hướng dẫn:
Trong M có Z proton , Z electron , N nơtron
X có Z’ proton , Z’ electron , N’ nơtron
⇒ Hệ phương trình:
\(\begin{array}{l} \left\{ \begin{array}{l} (2Z + N) + (6{\rm{Z}}' + 3N') = 196\\ (2{\rm{Z}} + 6{\rm{Z}}') - (N + 3N') = 60\\ (Z' + N') - (Z + N) = 8\\ (2{\rm{Z}}' + N' + 1) - (2{\rm{Z}} + N - 3) = 16 \end{array} \right. \Rightarrow \left\{ \begin{array}{l} Z = 13\\ Z' = 17\\ N = 14\\ N' = 18 \end{array} \right.\\ \Rightarrow {A_M} = 27;{\rm{ }}{{\rm{A}}_X} = 35\\ \Rightarrow {}_{13}^{27}M;{\rm{ }}{}_{17}^{35}X \end{array}\)
3. Luyện tập Bài 2 Hóa học 10
Sau bài học cần nắm:
- Sự liên quan giữa số đơn vị điện tích hạt nhân với số proton và số electron.
- Đề cập đến cách tính số khối của hạt nhân.
- Các khái niệm thế nào là nguyên tố hóa học, đồng vị, nguyên tử khối, nguyên tử khối trung bình...
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. 1 và 2
- B. 2 và 3
- C. 1, 2 và 3
- D. Cả 1, 2, 3, 4
-
- A. 2,4,5
- B. 2,3
- C. 3,4
- D. 2,3,4
-
- A. Trong một nguyên tử thì số nơtron luôn luôn bằng số electron
- B. Trong một nguyên tử thì số nơtron luôn luôn bằng số proton
- C. Trong một nguyên tử thì số proton luôn luôn bằng số electron
- D. Trong một nguyên tử số nơtron luôn luôn bằng số khối
-
Câu 4:
Nhận định nào sau đây đúng khi nói về 3 nguyên tử: \({}_{13}^{26}X;{}_{26}^{55}Y;{}_{12}^{26}Z\)
- A. X và Y có cùng số n
- B. X, Z là 2 đồng vị của cùng một nguyên tố hóa học.
- C. X, Y thuộc cùng 1 nguyên tố hóa học.
- D. X, Z có cùng số khối.
-
- A. 17.
- B. 20.
- C. 18.
- D. 16.
Câu 2- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao Chương 1 Bài 2
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị.
Bài tập 2.18 trang 8 SBT Hóa học 10
Bài tập 1 trang 11 SGK Hóa học 10 nâng cao
Bài tập 2 trang 11 SGK Hóa học 10 nâng cao
Bài tập 3 trang 11 SGK Hóa học 10 nâng cao
Bài tập 4 trang 11 SGK Hóa học 10 nâng cao
Bài tập 5 trang 11 SGK Hóa học 10 nâng cao
Bài tập 1 trang 14 SGK Hóa học 10 nâng cao
Bài tập 2 trang 14 SGK Hóa học 10 nâng cao
Bài tập 3 trang 14 SGK Hóa học 10 nâng cao
Bài tập 4 trang 14 SGK Hóa học 10 nâng cao
Bài tập 5 trang 14 SGK Hóa học 10 nâng cao
Bài tập 6 trang 14 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 2: Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 10
Lớp 10 - Năm thứ nhất ở cấp trung học phổ thông, năm đầu tiên nên có nhiều bạn bè mới đến từ những nơi xa hơn vì ngôi trường mới lại mỗi lúc lại xa nhà mình hơn. Được biết bên ngoài kia là một thế giới mới to và nhiều điều thú vị, một trang mới đang chò đợi chúng ta.
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK