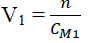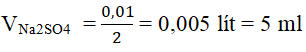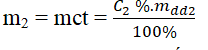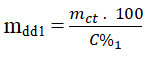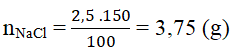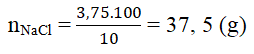Trình bày cách pha loãng một dung dịch theo nồng độ cho trước
Câu hỏi :
Trình bày cách pha loãng một dung dịch theo nồng độ cho trước?
* Đáp án
* Hướng dẫn giải
a) Pha loãng một dung dịch theo nồng độ mol/lit cho trước.
Tổng quát: Pha V2 ml dung dịch a có nồng độ CM2 (M) từ dung dịch A có nồng độ CM1 (M).
- Bước 1. Tìm số mol chất tan có trong V2 ml dung dịch A có nồng độ CM2 (M):
n = CM2 . V2
- Bước 2. Tính thể tích dung dịch A nồng độ CM1 (M):
+ Bước 3. Tính thể tích nước cần thêm là: V nước = V2 – V1
+ Bước 4. Pha chế dung dịch.
Ví dụ: Từ nước cất và các dụng cụ cần thiết, hãy tính toán và nêu cách pha chế:
100 ml dung dịch Na2SO4 0,1M từ dung dịch Na2SO4 2M
Giải
* Tính toán:
- Số mol chất tan Na2SO4 trong 100 ml dd Na2SO4 0,1M là:
nNa2SO4 = 0,1.0,1 = 0,01 (mol)
- Thể tích của dung dịch Na2SO4 2 M (trong đó có chứa 0,01 mol chất tan Na2SO4) là:
* Cách pha chế dung dịch:
+ Đong lấy 5 ml dung dịch Na2SO4 2M cho vào cốc chia độ 200 ml.
+ Thêm từ từ nước cất đến vạch 100 ml, khuấy đều ta được 100 ml dung dịch Na2SO4 0,1M.
b) Pha loãng một dung dịch theo nồng độ phần trăm (C%) cho trước.
Tổng quát: Pha chế m gam (mdd2) dung dịch A nồng độ C2 % từ dung dịch A nồng độ C1 %.
- Bước 1. Tính khối lượng chất tan A có trong m gam dung dịch A nồng độ C2 %
- Bước 2. Tính khối lượng dung dịch ban đầu.
- Bước 3. Tính khối lượng nước cần dùng pha chế.
mH2O = mdd2 - mdd1
Ví dụ: Từ nước cất và các dụng cụ cần thiết, hãy tính toán và nêu cách pha chế: 150 g dung dịch NaCl 2,5% từ dung dịch NaCl 10%.
Giải
Tính toán:
Khối lượng của NaCl có trong 150g dd NaCl 2,5% là:
Khối lượng dd NaCl ban đầu (có chứa 3,75 g NaCl) là:
Khối lượng nước cất cần dùng là: mH2O = 150 – 37,5 = 112,5 (g)
Cách pha chế dung dịch:
+ Cân 37,5 g dd NaCl 10% cho vào cốc thủy tinh (hoặc bình tam giác).
+ Cân 112,5 g nước cất (hoặc 112,5 ml) rồi từ từ cho vào cốc thủy tinh (hoặc bình tam giác) trên.
+ Khuấy đều ta được 150 ml dd NaCl 2,5%.
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Tổng hợp câu hỏi ôn tập Hóa Học lớp 8 cực hay, chi tiết !!
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 8
Lớp 8 - Năm thứ ba ở cấp trung học cơ sở, học tập bắt đầu nặng dần, sang năm lại là năm cuối cấp áp lực lớn dần nhưng các em vẫn phải chú ý sức khỏe nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK